哈佛大學(xué)的兩個團(tuán)隊將微流體技術(shù)引入單細(xì)胞RNA-Seq方法中,分別開發(fā)出Drop-seq和inDROP�����。2015年��,這兩種方法發(fā)表在同一期的《Cell》雜志上����。它們的出現(xiàn),讓快速����、低成本地分析數(shù)千個單細(xì)胞的基因活性成為現(xiàn)實���。
眾所周知����,大腦是一種復(fù)雜的結(jié)構(gòu)。它包括近860億個神經(jīng)元以及數(shù)十億個其他類型的細(xì)胞��。單細(xì)胞的基因表達(dá)分析能夠揭開細(xì)胞之間的差異�����,幫助繪制復(fù)雜組織的細(xì)胞多樣性圖譜���。不過����,如果每次只分析一個細(xì)胞��,那顯然不現(xiàn)實�。
于是,哈佛大學(xué)的兩個團(tuán)隊將微流體技術(shù)引入單細(xì)胞RNA-Seq方法中����,分別開發(fā)出Drop-seq和inDROP。2015年����,這兩種方法發(fā)表在同一期的《Cell》雜志上�����。它們的出現(xiàn)���,讓快速、低成本地分析數(shù)千個單細(xì)胞的基因活性成為現(xiàn)實���。
這兩種技術(shù)都利用微流體裝置將帶有條形碼的微珠和細(xì)胞一起裝入微小的液滴��。這些液滴在一個小型設(shè)備上生成����,沿著一根頭發(fā)寬的槽道流動�。條形碼附著到每個細(xì)胞的一些基因上,因此科學(xué)家們可以一次測序所有的基因��,追蹤每個基因的來源細(xì)胞���。
Drop-seq
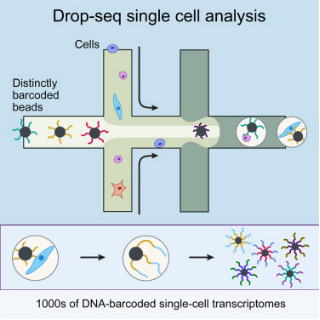
Drop-seq由哈佛醫(yī)學(xué)院Steven McCarroll領(lǐng)導(dǎo)的團(tuán)隊開發(fā)�。利用這種方法���,他們已經(jīng)分析了來自小鼠眼睛視網(wǎng)膜的44,800多個細(xì)胞的基因活性���,鑒定出39種不同類型的視網(wǎng)膜細(xì)胞。他們的下一步目標(biāo)是構(gòu)建大腦的整體結(jié)構(gòu)����,以便對參與正常神經(jīng)發(fā)育的基因有一個清晰的了解。
這些雄心勃勃的研究項目之所以能夠?qū)嵤?��,是因為Drop-seq的成本更低���,速度更快。據(jù)介紹�,利用Drop-seq,分析單細(xì)胞的基因活性僅需7美分�����。此外�,分析過程也相當(dāng)高效,每個科學(xué)家每天可以分析約1萬個細(xì)胞����。
inDrop
inDrop方法是由哈佛大學(xué)的系統(tǒng)生物學(xué)教授Marc Kirschner領(lǐng)導(dǎo)開發(fā)的����,與Drop-seq有些類似�����,但不完全相同��。研究小組利用這種方法來分析小鼠的數(shù)千個胚胎干細(xì)胞和分化細(xì)胞�,以便更好地了解干細(xì)胞分化。
Drop-seq的微珠庫中有1600萬個條形碼�����,而inDrop方法只產(chǎn)生約15萬個條形碼����,這意味著它每次運(yùn)行處理的細(xì)胞數(shù)較少。不過��,當(dāng)研究人員想分析極少量的組織樣本時�,inDrop可能更有優(yōu)勢。因為它捕獲細(xì)胞的比例高于Drop-seq�����。

測序技術(shù)大比拼
在各種單細(xì)胞RNA測序技術(shù)被陸續(xù)開發(fā)出以后,相信大家的選擇困難綜合征又犯了�����,不知道該如何選擇���。好在,德國慕尼黑大學(xué)的研究人員比較了幾種常用的幾種方法��,包括Smart-Seq�����、CEL-Seq����、SCRB-seq以及Drop-seq。他們生成并分析了479個小鼠胚胎干細(xì)胞的RNA-Seq數(shù)據(jù)�。
研究人員發(fā)現(xiàn),盡管所有方法的準(zhǔn)確性相似�,但是Smart-seq的靈敏度最高,CEL-seq最為精確��,而SCRB-seq和Drop-seq最為高效。有了這個分析�,相信你在選擇方法時心里有底了吧。
免責(zé)聲明:部分圖片來源于網(wǎng)絡(luò)����,如有侵權(quán)請聯(lián)系刪除!

